疾病治疗
胡凯主任:选择CAR-T还是自体移植?强强联合又会擦出怎样的火花?
近年来,嵌合抗原受体T(CAR-T)细胞疗法作为治疗癌症最有效的方法之一,在淋巴瘤的治疗中表现出十分满意的疗效,而自体造血干细胞移植(ASCT)亦是治疗淋巴瘤非常重要的手段。淋巴瘤患者什么时候选择CAR-T?什么时候选择自体移植?两种治疗手段如何巧妙联合,为患者带来更多治疗的希望?本文中,北京高博博仁医院成人淋巴瘤/骨髓瘤专家胡凯主任以“CAR-T与自体移植的巅峰较量——选择时机?可否联合?”为题,为大家详细讲解了CAR-T与自体移植在淋巴瘤治疗中的进展与应用。

一、传统ASCT的治疗选择时机及治疗疗效
ASCT可作为高危一线巩固治疗及复发/难治二线有效治疗后的巩固治疗,但对化疗不敏感的患者ASCT疗效不佳。
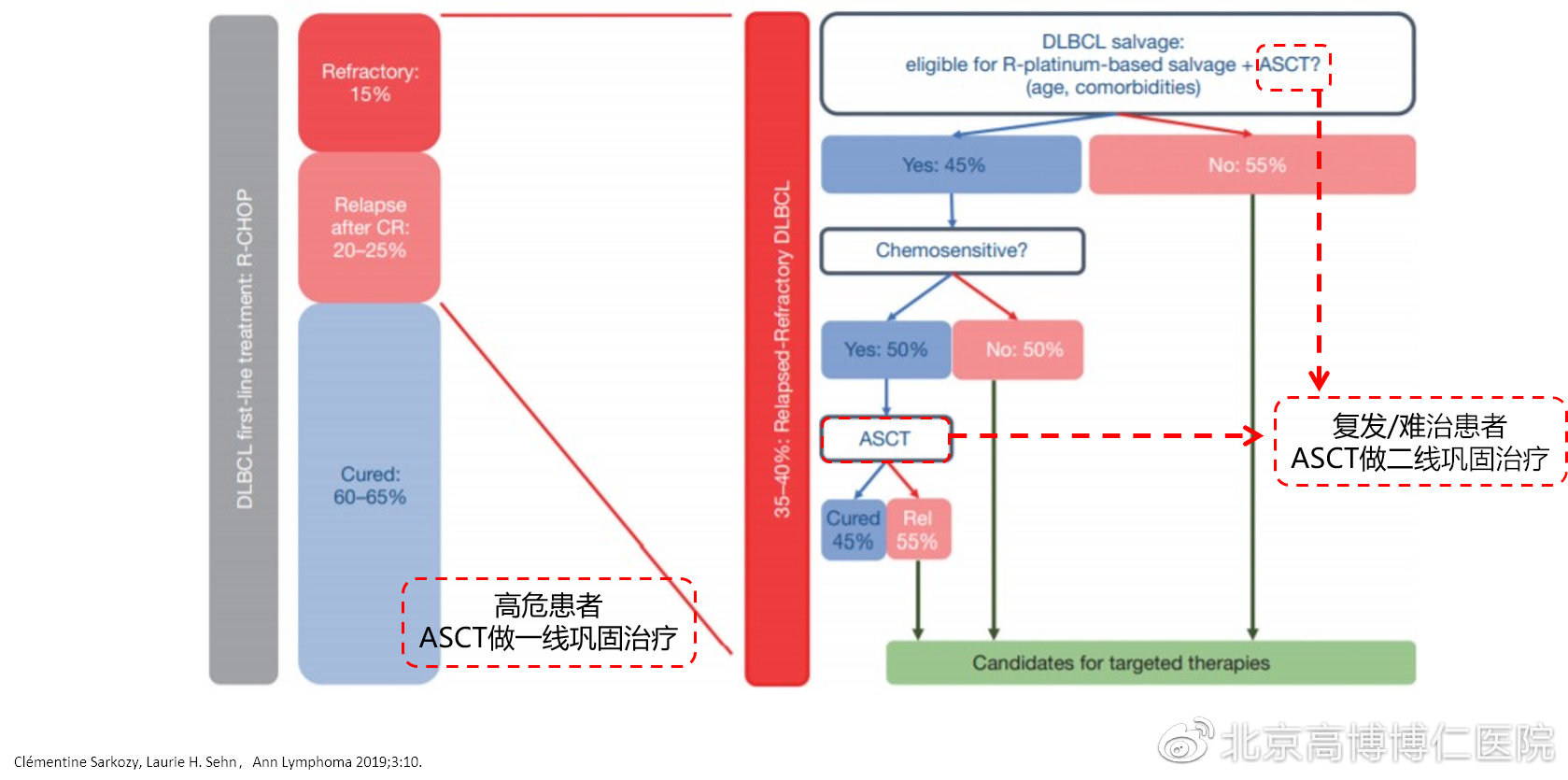
1、ASCT作为高危患者一线巩固治疗,是否提高了生存?
首先,什么是“高危因素”?
Ø 肿瘤负荷高?IPI指数中-高危、多发结外病灶、结外大包块>7cm、中枢及骨髓侵犯。
Ø 患者体能及一般状况?ECOG评分、合并症指数。
Ø 病理及遗传学高危因素?高级别、FISH(MYC、TP53断裂)。
Ø 分子高危因素?TP53突变、分子高级别。
Ø 治疗敏感性差?中期PET-CT(第2及第4个疗程)评估未达到客观缓解率(ORR)。
(1)将IPI评分作为高危因素,ASCT一线巩固提高了IPI高危患者的生存。
一项随机对照研究显示,当未区分IPI评分时,化疗和ASCT组的生存率差异不大【2年无进展生存(PFS)率:69%vs55%;2年总生存(OS)率:74%vs71%】。但IPI高危组中,ASCT组的生存率明显高于化疗组(PFS率:75%vs41%;2年OS率:82%vs64%)。可见,ASCT一线巩固提高了IPI高危患者的生存。
(2)将中期PET-CT疗效评估作为高危因素,ASCT一线巩固提高了生存。
一项研究基于中期PET-CT疗效评估,探索了弥漫大B细胞淋巴瘤(DLBCL)患者ASCT一线巩固治疗的效果。对于第2疗程PET无效、第4疗程有效者,缓解后行ASCT作为巩固治疗。研究结果显示,第2疗程及4疗程PET均有效者,2年PFS率 89.9%,OS 率94.8%。第2疗程PET无效、第4疗程有效者,ASCT后生存率明显提高,2年PFS率 89.9%,OS 率92.8%。可见,ASCT巩固治疗提高了该组患者的生存。所以,疗效评估对于临床后续的治疗以及整体治疗策略的制定是非常重要的。
2、复发/难治的患者,对于化疗敏感,ASCT二线巩固可提高患者的生存
复发/难治患者对于化疗敏感,后续做ACST二线巩固是否能提升患者生存呢?一项研究纳入了215例复发难治B细胞非霍奇金淋巴瘤(B-NHL)患者,将高剂量化疗后有效的患者分成化疗/放疗组(N=54)和ASCT(N=55)组,评估了化疗/放疗与ASCT二线巩固对患者生存的影响。研究结果显示,ASCT和化疗/放疗的有效率为:84%vs44%,5年无事件生存(EFS)率:46%vs12%,5年OS率:53%vs32%。可见,移植大概提高了20%的长期生存率。
但是,有些复发/难治患者虽然对二线化疗敏感,也可能对ASCT效果不佳。ASCT治疗预后不佳的因素有:① 诊断后12个月内复发;② aa-IPI(年龄调整的IPI评分)大于1分;③ 在ASCT时PET-CT显示未能获得比部分缓解(PR)更好的治疗。此外,难治/复发DLBCL患者,能够接受ASCT的比例低。HD-ASCT属于强效疗法,部分患者可能无法耐受此治疗;对于符合条件的复发或初始治疗无效的患者,挽救化疗序贯高剂量自体干细胞移植(HD-ASCT)是标准治疗,二线患者取得治愈的可能性仅约10%。
小结
ASCT是否需要作为“高危患者”一线巩固治疗,目前尚有争议,需要明确界定“高危因素”是哪些。中国的患者就诊期较晚、复发/难治后能选择的新药较少,对于“高危患者”,建议一线ASCT巩固治疗。ASCT作为复发后再次缓解的二线巩固治疗,对于化疗敏感的患者疗效确定,但有条件选择ASCT的患者有限;化疗不敏感的患者疗效差。
二、CAR-T治疗时代,CAR-T能否用疗效来挑战ASCT地位?
CAR-T细胞治疗的出现是淋巴瘤治疗的里程碑事件,它在淋巴瘤治疗体系中发挥了重大的作用,尤其是B细胞淋巴瘤的治疗效果再上一个台阶。那相较于自体移植,CAR-T的效果如何呢?
1、关注难治/复发患者,CAR-T vs ASCT疗效如何?
国外一项研究(ZUMA7研究)对比了CAR-T与ASCT作为难治/复发患者二线治疗的疗效与安全性。研究结果显示,CAR-T组的无事件及无进展生存率(mEFS及PFS)是ASCT组的4倍。CAR-T对比ASCT作为难治/复发二线治疗有生存优势,年龄≥65岁者以及肿瘤负荷高的患者CAR-T组EFS均较ASCT组明显延长,且CAR-T治疗未增加不良反应。原发耐药或1年内复发DLBCL患者,CAR-T作为二线治疗对比ASCT有明显优势。
2、高危一线巩固,CAR-T是否有意义?
既然CAR-T治疗复发难治患者的疗效优于移植,那有没有可能用于一线治疗呢?ZUMA 12研究对此进行了探索。该研究采用CAR-T治疗一线高危大B细胞淋巴瘤,研究结果显示,CAR-T作为高危患者一线治疗的ORR为89%,完全缓解(CR)率为78%;12个月的PFS率81%,EFS 率3%,持续缓解(DOR)率75%,OS率91%,而且安全性可控。
小结
CAR-T vs ASCT作为二线治疗,有明显生存及疗效优势,副反应可控,尤其对原发耐药及诊断后一年内复发的患者;CAR-T vs ASCT作为一线巩固,缓解率高,安全性可控,生存值得期待。
三、当CAR-T与ASCT相遇,会擦出怎样的火花?
CAR-T联合ASCT治疗的模式有协同作用的理论依据。淋巴瘤具有介于白血病和实体瘤之间的特征,肿瘤免疫抑制微环境(TME)会限制CAR-T功能,而输注CAR-T细胞之前强的预处理清淋方案能破坏TME,更有效增强CAR-T细胞的功能和增殖。首先,ASCT的强预处理方案后,免疫抑制性TME会减少,肿瘤负荷明显下降;其次,在造血重建期间给予CAR-T细胞治疗,可以根除移植后的残余疾病,从而降低复发率。
国内外多项研究表明,CAR-T联合ASCT治疗的模式可以进一步提高抗肿瘤活性并降低复发率。
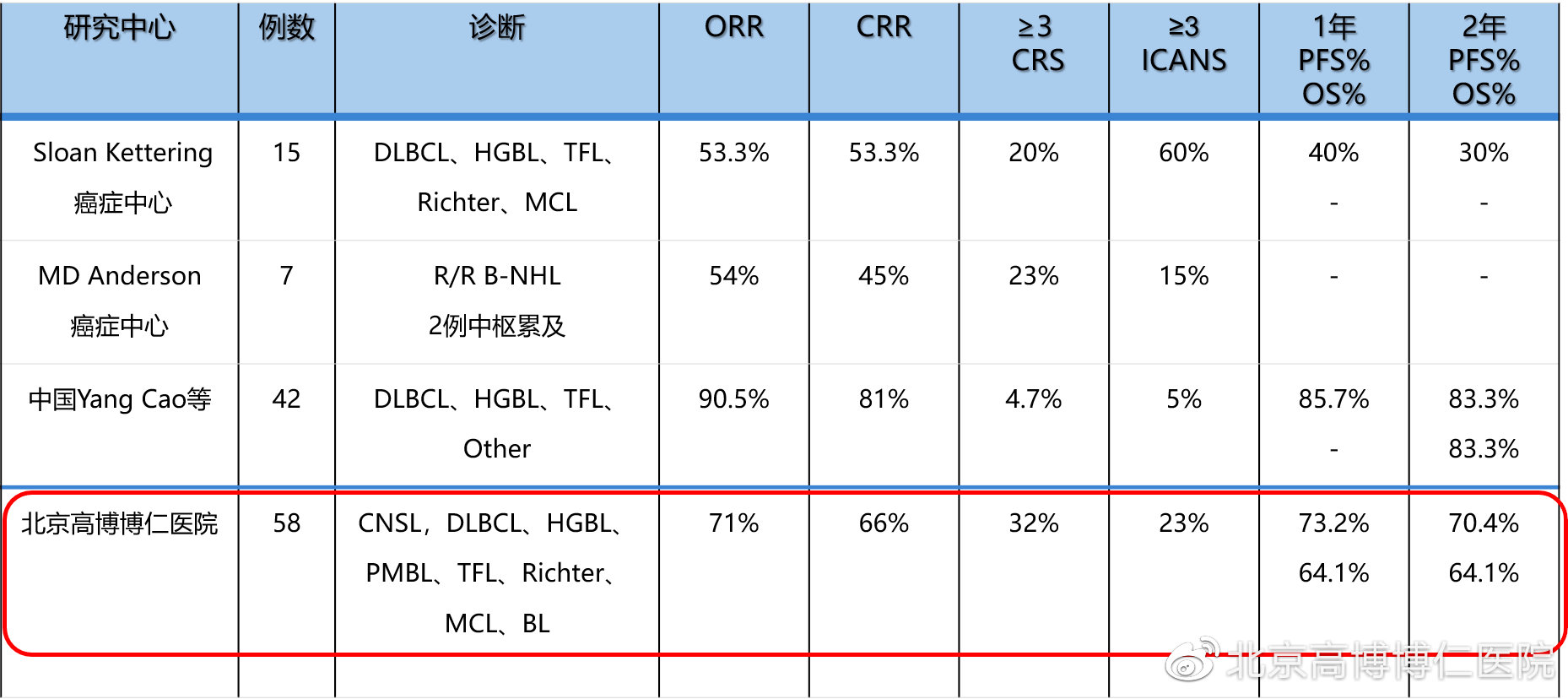
小结
CAR-T与ACST具有协同作用,对于特定患者可进一步加深缓解程度,延长生存期,且安全性可控;CAR-T联合ASCT治疗的模式可以进一步提高抗肿瘤活性并降低复发率。
四、治疗方案的选择及病例分享
治疗纷繁复杂,如何为患者选择治疗方案呢?
首先,治疗前针对疾病进行充分沟通,了解目前的疾病状态,制定完整细致的全套治疗方案。其次,在治疗过程中充分沟通,争取患者及家属最大程度的配合。最后,建立完整的病情评估体系及流程,并根据病情调整治疗方案,治疗后进行密切的随访。
病例一,男性,55岁,DLBCL,非生发中心亚型
入我院治疗前:
Ø PET-CT:病灶累及纵膈、腹腔、甲状腺、肝胃间隙、心包、胃、腹膜、肠管等。
Ø 心脏超声提示心包积液(大量);冠脉CTA提示:肺栓塞,右心底软组织肿块累及右心房、右心室。
Ø 外院R-CDOP×5达到PR;PD-1+ICE,疾病进展(PD)(左顶叶皮层下淋巴瘤合并出血及脑水肿);RCEPP×2疾病进展。
2021年3月我院接诊,诊断:弥漫大B细胞淋巴瘤(IVA期)。
Ø PET-CT:胸膜、双肺、心脏肿物、盆腔小肠、多发肌肉占位,淋巴瘤多发浸润。
Ø 超声穿刺活检(左下肢新发),DLBCL,non-GCB;免疫组化:CD19(++)。
Ø 血液肿瘤相关基因突变筛查检测:ARIDlA、BTG2、PIM1、AIM1、ALK、BT、TG2、CCND3、CD58、CD79B、DUSP2、HISTIHIE、KMT2D、MYD88、NPM1。
Ø 心脏超声:右房室多个中等偏低回声团块,横跨三尖瓣,与右房、室壁粘连,7.3×4.4cm。
针对该患者,我们临床采用来那度胺+BTK抑制剂+Pola-BR减瘤策略,后进行人源化CD19 CAR-T治疗。之后采集自体干细胞,行ASCT+人源化CD22 CAR-T治疗,患者最终达到无病生存。
病例二,女性,31岁,原发纵膈大B细胞淋巴瘤
入我院治疗前:
Ø 免疫表型:异型淋巴细胞Bc1-2(+80%),Bcl-6(+),CD10(-),CD19(+),CD20(+),CD22(+),CD23(+),CD30(+),CMVC(+30%),EBER(-),K167(+90%),MUM-1(+)。
Ø 外院采用R-DA-EPOCH×4、GVD+PD1单抗×2治疗,疾病进展(头颅核磁发现小脑占位),高剂量MTX+GVD+PD-1单抗+鞘注仍然进展。
2019年9月我院接诊,诊断:原发纵膈大B细胞淋巴瘤。
Ø 胸部CT:左前纵隔内见肿块影,4.7×7.6×8.9cm,右侧腋窝淋巴结肿大。
Ø 头颅核磁:小脑异常信号。
临床给予减瘤方案×3次+自体外周血造血干细胞采集,自体造血干细胞移植(预处理BEAM方案)+鼠源CD19 CAR-T治疗,并联合纵膈局部放疗、PD1单抗治疗,后给予人源化CD20 CAR-T治疗,PD1单抗治疗。2020年9月PET-CT评估显示CR,目前无病生存。
病例三,男性,21岁,Burkitt淋巴瘤
入我院治疗前:
Ø 就诊于外院普外科,诊断为“肠套叠”,手术:肿瘤直径约2.5cm,侵及肠壁全层,回盲瓣、阑尾;结肠周围淋巴结可见肿瘤累及;
Ø FISH结果提示该标本存在C-MYC基因断裂重组。外院给予Hyper-CVAD-A方案及Hyper-CVAD-B方案,疾病复发。
2019年1月我院接诊,诊断:伯基特淋巴瘤IVA期。2019年10月超声引导下穿刺活检术病理回报提示(左腹部),Burkitt淋巴瘤。
Ø 免疫组化:CD20(+,95%强),CD19(+,95%强),CD22(+,95%强),CD38(+,95%强),CD10(+),C-myc(85%+)TdT(-),P53(95%,强弱不一,野生型)PD-1(-),PD-L1(背景细胞+),BCL2(-),BCL6(+),Ki-67(95%+),原位杂交结果:EBV-EBER(-)。
Ø 血液肿瘤相关基因突变筛查检测:TP53、ID3、GNA13、TPMT变异。
临床给予减瘤方案×2+鞘注2次,后行鼠源CD19 CAR-T治疗,采集自体外周血造血干细胞,自体造血干细胞移植(预处理BEAM方案)+人源化CD22 CAR-T治疗,后行人源化CD20 CAR-T巩固,2020年9月PET-CT评估显示无活性代谢灶。
结语
针对复发/难治弥漫大B细胞淋巴瘤(R/R DLBCL),减瘤化疗过程中应根据患者情况及治疗效果适时采集造血干细胞。减瘤后有些患者能够达到完全缓解(CR):如果是二线化疗达到CR,后续可以做自体移植,按传统方法治疗;如果是≥三线化疗才达到CR的患者,单纯做自体移植往往不够,建议做自体移植联合CAR-T治疗。
还有一些患者减瘤治疗没有达到CR,这部分患者分为两类:一类是部分缓解(PR),一类是疾病稳定/进展(SD/PD)。针对PR患者,建议先做CAR-T进一步降低肿瘤负荷,达到CR后再做自体移植联合CAR-T治疗;针对SD/PD患者,不建议继续化疗,可以尝试免疫治疗。即便免疫治疗只能达到部分缓解,至少能为患者争取到休养生息的时间,可能改善患者整体的状态,后续再尝试其他的治疗方案。
总的来说,R/R DLBCL的治疗策略强调个体化和精准化治疗,治疗的每一步都要认真思考、反复斟酌与密切观察。
■ 本文专家介绍

主任医师,医学博士,成人淋巴瘤专家。
高博医学(血液病)北京研究中心北京高博博仁医院血液四科(成人淋巴瘤科)主任。内科毕业于华西医科大学,2012年获得北京大学医学部内科血液病专业博士学位。2005年至2019年就职于北京大学第三医院,2019年至今就职于北京高博博仁医院。目前从事血液恶性肿瘤的多学科综合治疗,擅长淋巴瘤、多发性骨髓瘤、白血病的早期诊断,以内科化疗为主的综合规范化治疗、分子靶向治疗、自体/异体造血干细胞移植及生物治疗,对生物标志物指导下的免疫治疗有深入研究,熟悉掌握淋巴瘤的最新国际诊疗规范。参与20余项国际、国内多中心临床研究,及时掌握国际淋巴瘤、多发性骨髓瘤诊治前沿新动向。第一作者及通信作者发表中英文论文30余篇,参编参译著作5本。
学术任职:中国老年学学会老年肿瘤专业委员会委员,中国健康管理协会健康科普专业委员会委员,中国医药教育协会造血干细胞移植及细胞治疗专业委员会委员,北京肿瘤协会临床研究专业委员会委员,北京市医学会血液委员会青年委员。
科研成果及获奖情况:
1.实用新型专利,发明名称:一种分离装置,专利号:201420394032X
2.EHA口头汇报:
1). Genetic landscapes and curative effect of CAR T-cell immunotherapy in relapse and refractory DLBCL patients.
3.ASH口头汇报:
1). Allogeneic Hematopoietic Stem Cell Transplantation with Conditioning Including Donor Humanized CAR-T Cells for Refractory/Relapsed B-Cell Non-Hodgkin Lymphoma and Multiple Myeloma
2). Auto Hematopoietic Stem Cell Transplantation Combined with Another Target Humanized CAR-T Cells for Refractory/Relapsed B-Cell Non-Hodgkin Lymphoma after Failure of Murinized CD19-CAR-T Therapy
各位血液肿瘤战友,想及时了解疾病治疗进展及最新临床试验信息,听医生专业答疑解惑,与病友交流分享经验,等等,均可扫描下方成人淋巴瘤科助理二维码进行咨询哦~

【成人淋巴瘤科】




 京公网安备11010602050084号
京公网安备11010602050084号

