医院新闻
学术动态 | Clinical Cancer Research发表克晓燕教授、胡凯主任团队CD7 CAR-T治疗最新研究成果
* 文章转载自生物医学工程高精尖创新中心
肿瘤学顶 级期刊《Clinical Cancer Research》(影响因子13.801;17/245,Oncology,Q1)近日在线发表北京航空航天大学医学科学与工程学院,生物医学工程高精尖创新中心于健教授团队、陈伟副教授团队及高博医学(血液病)北京研究中心北京高博博仁医院克晓燕教授、胡凯主任团队合作的最新研究成果“Single-cell transcriptomics reveals immune reconstitution in R/R T-ALL/LBL patients with donor-derived CD7 CAR-T therapy”。医学科学与工程学院陈伟副教授、博仁医院石慧医生、医学科学与工程学院在读博士生刘卓君及博仁医院杨帆医生为该论文的共同第一作者,于健教授、博仁医院胡凯主任及克晓燕教授为该论文的共同通讯作者。北京航空航天大学为该论文的第一单位、第一通讯单位。本研究得到了国家自然科学基金、北京市生物医学工程高精尖创新中心以及格物致和生物科技(北京)有限公司平台条件的支持。

复发/难治性急性T淋巴细胞白血病/ T细胞淋巴母细胞淋巴瘤(T-ALL/LBL)预后极差,约25%的患者在接受异基因移植后仍表现为复发/难治性,无药可医。尽管CD7 CAR-T细胞疗法为此类患者带来了生存希望,然而对于该疗法的长期疗效以及患者接受治疗之后的免疫重建等关键问题仍亟待解决。本研究进行了一项一期非盲临床试验(ChiCTR2200058969),以评估供体来源的CD7 CAR-T细胞疗法在7名复发/难治性T-ALL/LBL患者中的安全性及疗效,并借助单细胞转录组测序分析对T-ALL/LBL患者治疗前后的免疫功能进行了详细评估。
临床试验结果显示:7名患者在接受CAR-T治疗28天后均达到了完全缓解,且3个月内未出现复发。在随访期内,3名患者在接受治疗后死亡,另有3名患者复发(图1)。
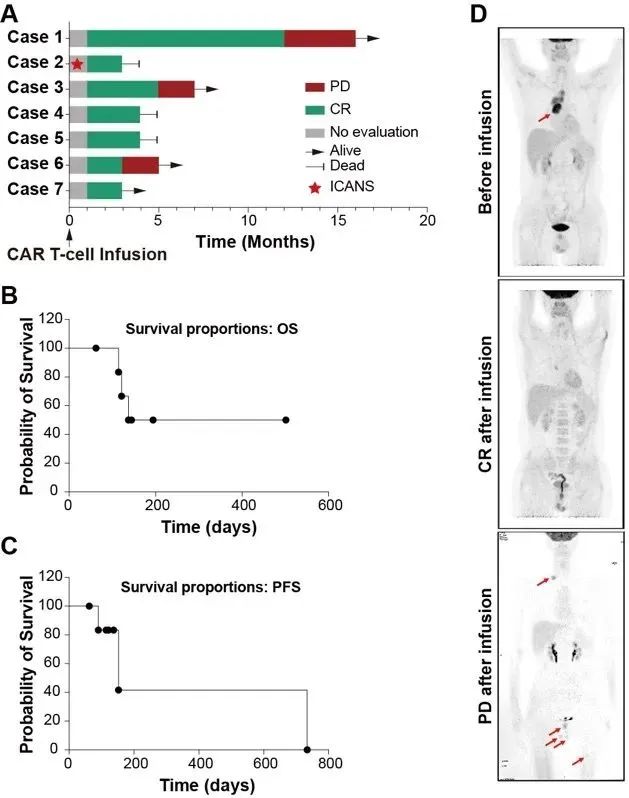
图1:复发/难治性T-ALL/LBL中CD7 CAR-T细胞治疗的疗效。(A)7名患者的临床反应和随访情况;(B)7名患者的总生存期;(C)7名患者的无进展生存期;(D)1例患者CAR-T治疗前、治疗后完全缓解及治疗后复发的PET-CT图
在接受CD7 CAR-T治疗后第11天左右,所有患者体内的CD7+ T细胞消失,而CD7- T细胞急速扩增。截至随访日期结束,CD7+ T细胞并未恢复生长态势。本研究选取典型患者治疗前后的外周血进行了单细胞转录组测序并行分析,首次阐明CD7 CAR-T治疗后免疫重建的CD7- T细胞具备完善的增殖能力和免疫功能。此外,本研究意外发现免疫重建后的CD7- T细胞表现出与自身免疫病相关的特征(图2)。

图2:CD7 CAR-T细胞治疗前后T细胞功能对比。(A)CAR-T治疗前后T细胞中T细胞活化、T细胞受体信号传导和T细胞受体相关基因集表达水平变化;(B)KEGG通路富集网络;(C)相同患者的治疗前后CD7- T细胞GSEA热图
临床试验结果表明:严重感染对于接受CD7 CAR-T治疗的患者极为致命。本研究首次在单细胞转录组水平证实:CAR-T治疗后发生的严重感染与患者体内单核细胞丢失密切相关。为了规避CAR-T治疗后的严重感染,如何防止单核细胞丢失是未来优化CD7 CAR-T临床应用的一大挑战(图3)。
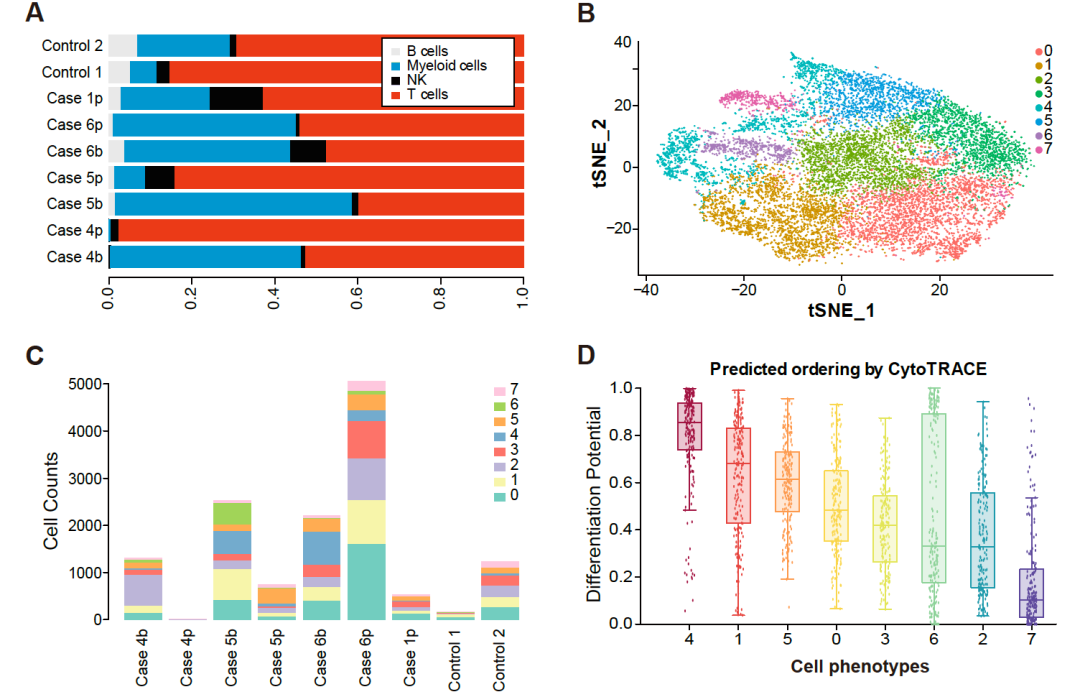
图3:免疫细胞重建与感染的关系。(A)每个scRNA测序样品中主要细胞类型的占比;(B)CD14+单核细胞分群及tSNE降维;(C)每个样本中八个单核细胞亚群的细胞计数;(D)单核细胞亚群的分化潜力排序
临床试验结果显示患者在接受CD7 CAR-T治疗后有复发的情况。本研究通过单细胞测序分析发现白细胞谱系中S100A8和S100A9的异常高表达是T-ALL/LBL复发的潜在标志物,表明治疗后对于S100A8/A9的监测可为维持患者完全缓解状态提供帮助,若有复发迹象,可立即桥接二次移植(图4)。
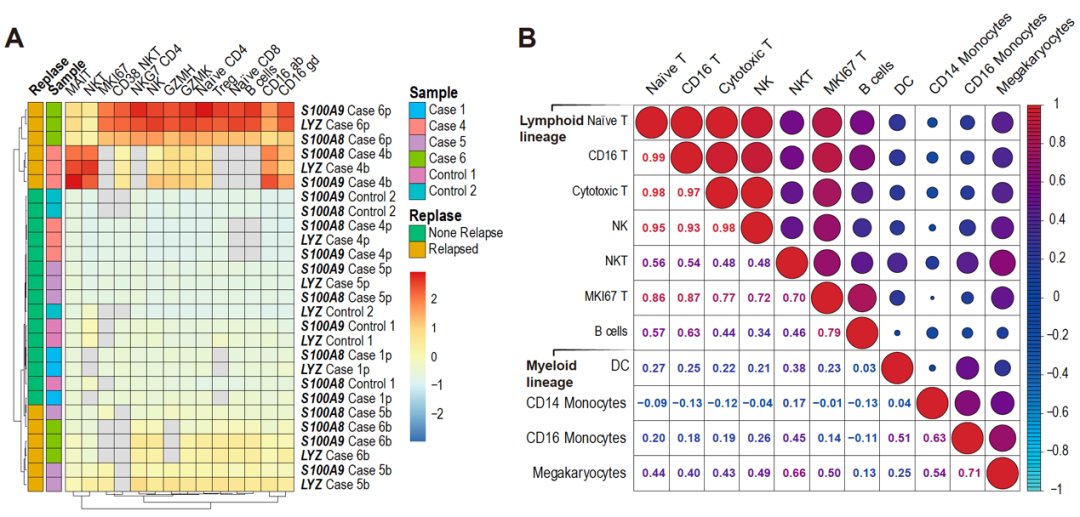
图4:T-ALL/LBL复发相关标志物表达谱。(A)测序样本中不同T细胞亚型中LYZ、S100A8和S100A9的表达谱热图;(B)同一样本中不同PBMC细胞类型的S100A8和S100A9表达相关性矩阵
总 结
本研究将临床试验与高通量单细胞转录组测序相结合,揭示了接受CD7 CAR-T治疗真实患者的免疫稳态细胞水平动态,对于复发/难治性T-ALL/LBL的临床治疗决策起到了十分重要的作用。目前正在通过招募更多患者进行长期临床观察,以进一步评估CD7 CAR-T细胞治疗及后续合并疗法的疗效。
图片来源 | Clinical Cancer Research官网





 京公网安备11010602050084号
京公网安备11010602050084号

