疾病治疗
吴彤主任:如何有效减少移植后复发?掌握4个关键点!
移植通常被认为是治愈血液肿瘤的重要手段,也被患者和家属寄予厚望,如何提高移植的疗效,减少疾病复发,减轻患者家庭困扰?北京高博博仁医院造血干细胞移植学科带头人吴彤主任特别为大家带来专业科普解读。
异基因造血干细胞移植(allo-HSCT)后常见的合并症主要有三类,包括移植物抗宿主病(GVHD)、感染和复发。目前北京高博博仁医院通过优化的个体化移植方案,已经极大地提高了allo-HSCT的安全性及疗效。
移植后复发往往是患者及家属非常关心的问题。根据吴彤主任多年的临床实践,allo-HSCT后预防复发,主要与四个因素有关:移植前良好的疾病控制,有效的移植方案,健康的供者,移植后微小残留病(MRD)监测与维持治疗。
要素一:移植前良好的疾病控制
移植前为什么要尽量达到疾病的完全缓解(CR)?多项研究显示,对于难治/复发的急性B淋巴细胞白血病(B-ALL),疾病未达到CR进行挽救性allo-HSCT,移植后5年生存率仅20%左右,而通过CD19 CAR-T治疗90%以上的患者能够达到MRD阴性的CR,这时再进行allo-HSCT的总体生存率可达80%以上。对于急性髓系白血病(AML)也是如此,与挽救性移植和CR但MRD阳性时移植相比,MRD阴性状态下移植复发率显著降低、生存率明显提高。因此,移植前应力争达到MRD阴性的CR,这是降低移植后复发的关键因素之一。
1、如何取得良好的疾病控制?
目前对于绝大多数急性白血病来说,化疗仍然是一线治疗方案。化疗后骨髓原始细胞<5%、血象恢复正常、白血病相关症状缓解、髓外病变消失即可判定为CR。然而部分患者经过2个标准疗程化疗后仍无法缓解,即属于原发耐药的难治病例。也有部分患者达到CR后MRD不能转阴或CR后又复发,这些都属于难治/复发范畴,通常对常规化疗的反应较差,亟需更有效的治疗手段。
对于难治/复发的B-ALL,目前可采取CAR-T、抗体和靶向药物等多种治疗方案。北京高博博仁医院目前已经成功应用CD19、CD22、CD20、CD70等靶点的CAR-T治疗,能够使绝大多数难治/复发的B-ALL患者达到MRD阴性的CR。在抗体药物方面,有CD3/CD19双抗、CD22单抗等新药可以选择,抗体药物不仅可使部分患者达到CR,也能够作为CAR-T前的减瘤手段。对于Ph+ ALL,可以选择TKI类靶向药物治疗,一些患者应用达沙替尼或伊马替尼效果欠佳,这时要测药物浓度及耐药基因,如果药物浓度偏低则需要加量,如果有耐药基因则需要换用敏感的TKI类药物。
对于难治/复发的T-ALL,北京高博博仁医院潘静主任团队采用供者来源CD7 CAR-T,取得了重大突破,90%达CR,5%达到部分缓解。但需要注意的是仅做过化疗的难治/复发的T-ALL,供者来源CD7 CAR-T后无法自行恢复造血,必须桥接allo-HSCT;而移植后复发的T-ALL,供者来源CD7 CAR-T后绝大多数造血是可以恢复的。T-ALL目前也有奈拉滨、CD38单抗及靶向药物可以选择。
对于难治/复发的AML,主要的治疗选择仍然以靶向药物为主,如去甲基化药物(地西他滨、阿扎胞苷),BCL-2抑制剂(维奈克拉),Flt3抑制剂(索拉非尼、舒尼替尼、米哚妥林),TKI类药物(伊马替尼、达沙替尼、普纳替尼)等。抗体类药物主要针对CD33、CD38靶点等。在AML的CAR-T治疗方面,北京高博博仁医院已经开始了先行探索并取得了初步的成功,需要注意的是,AML进行CAR-T治疗后同样无法恢复造血,需桥接allo-HSCT。
北京高博博仁医院可以采用深度测序查339种血液肿瘤相关的基因突变及筛查靶向药物,可以更好地指导靶向药物的选择。
2、选择移植要趁早
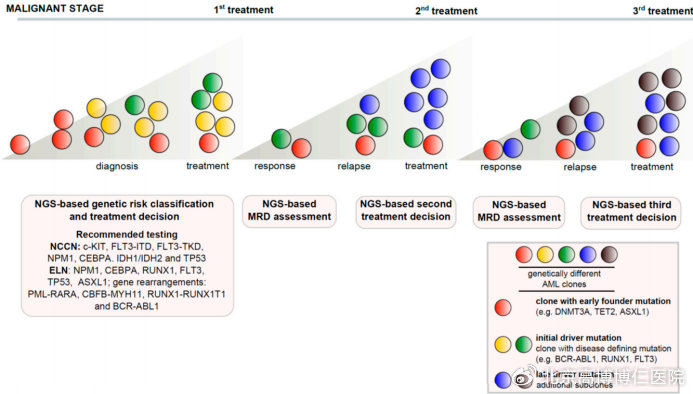
注:红、黄、绿色代表白血病发病初期的细胞;蓝、黑色代表晚期突变导致复发的白血病细胞。
在初诊时,会根据染色体、融合基因和基因突变等对疾病的危险度进行分层。高危者化疗治愈率低,应在疾病缓解后早期移植,这时肿瘤细胞大多对化疗/放疗敏感,容易被移植预处理的治疗所清除,因此移植后复发风险会明显降低。相反,如果疾病多次复发,在疾病的晚期移植,肿瘤细胞不断发生克隆演变导致耐药,各种治疗再难达到CR或MRD阴性,则移植后的复发率会显著增高。另外,多线治疗过程当中,免疫功能受损导致感染的风险增加以及治疗造成的多脏器损伤,也会增加移植的风险,降低移植的成功率。
要素二:制定有效的移植方案
移植方案包括预处理方案及合并症(GVHD、感染、复发等)的预防与治疗方案。应根据疾病的恶性程度、病程长短、既往的治疗、移植前的疾病状态、年龄、患者的一般状态及移植类型等定制个体化移植方案,兼顾移植的疗效和安全性。
1、如何选择预处理方案?
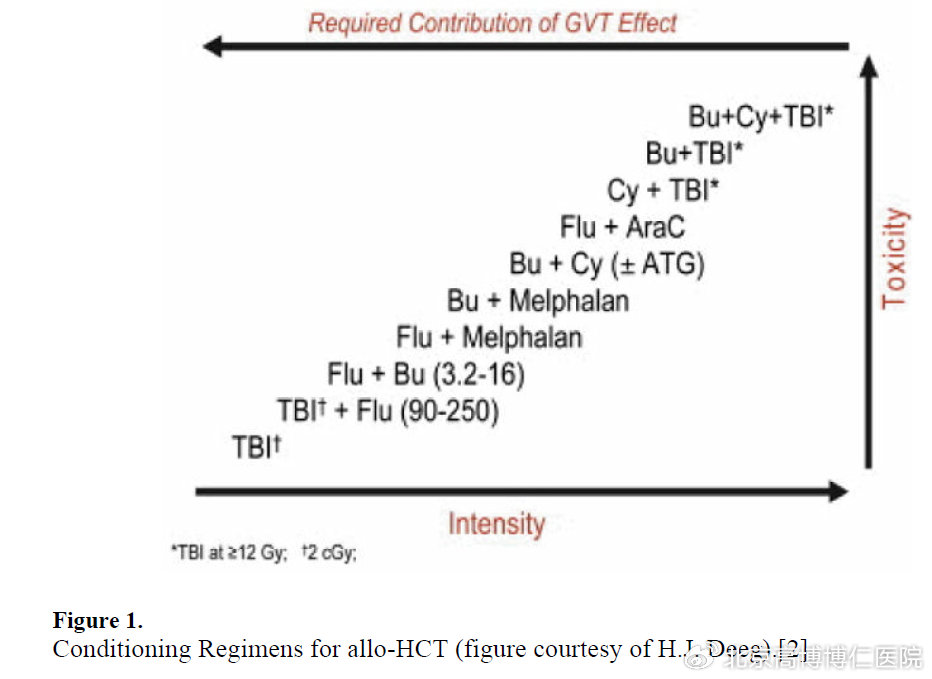
随着预处理强度的增加对肿瘤细胞的杀伤作用可能会增强,但同时治疗相关的毒性也会增加,即增加移植风险,虽然复发率有所降低,但非复发死亡率会有所增加,最终的长期无病生存率并未明显提高。因此,需要根据患者的具体情况制定适宜的、有效且安全的预处理方案。
北京高博博仁医院对移植预处理方案的制定已经积累了较丰富的成功经验。对于达到完全缓解的中、低危患者,可选择常规的预处理方案;对于高龄、经过多线治疗后存在脏器损伤的患者及二次allo-HSCT,需要选择减低毒性的预处理方案;而对于高危或难治/复发的患者,则需要在常规预处理方案前加用降低肿瘤负荷的治疗,提高杀伤肿瘤的强度。另外,治疗前MRD状态也会影响到预处理方案的选择,对于MRD阳性的患者需要选择更高强度的预处理方案。
2、免疫抑制剂的应用
移植后供者淋巴细胞会引起GVHD反应,因此需要应用免疫抑制剂来抑制免疫反应,避免造成严重的后果,但免疫功能被抑制后容易发生感染等不良事件,因而免疫抑制剂的应用也是关乎移植成败的重要因素。
☆ 对于复发风险较高的患者,免疫抑制剂应维持在相对低的水平;
☆ 如果没有活动性GVHD,免疫抑制剂适当早一些开始减量;
☆ 对于复发风险高的患者,可以用具有既抗GVHD又抗白血病双重作用的药物(如甲氨蝶呤等)替代一部分环孢素或他克莫司。
要素三:供者选择非小事
Allo-HSCT就是用供者健康的造血干细胞帮助患者重建正常的造血与免疫系统的一种治疗方法,因此供者造血干细胞质量以及供者的免疫功能是否健康尤为重要。
目前国际上关于移植供者选择建议考虑的相关因素包括:年龄、性别、血型是否相同、体重差别、KIR配型、非血缘对等性、患者针对供者HLA的特异性抗体(DSA)等。美国输血协会移植手册中指出,移植供者选择应遵从以下原则:造血功能正常、免疫功能正常、无恶性肿瘤病史、无传染性疾病(乙肝除外)及能耐受造血干细胞采集。
通过北京高博博仁医院的临床实践发现,除了美国输血协会移植手册中提到的基本原则外,血液和免疫系统疾病相关遗传易感基因变异(900+种)也是供者选择的重要参考因素之一。
要素四:移植后MRD监测与维持治疗
1、MRD监测不能少
移植后的MRD监测与维持治疗对移植的成败具有重要影响。移植后骨髓形态学达到CR时,体内仍可能残存少量的肿瘤细胞,这些用更敏感的方法才能检测得到的残留的肿瘤细胞被称MRD,是导致疾病复发的隐患。
MRD的检测方法包括流式、融合基因定量、二代测序(NGS)等。流式是检测MRD最常用的方法之一,它能够检测到10-4级别的MRD,可谓是万里挑一的检测技术;而对于流式检测已经阴性的情况,还可以选择更为敏感的融合基因定量及NGS方法,它能够检测到10-6级别的MRD,即百万分之一。
需要注意的是,融合基因定量虽然比流式更加敏感,但只适合少部分存在融合基因的患者;不是所有的基因突变都适合做MRD的标记进行监测,根据ELN(欧洲白血病网)的建议,WT1的表达不应该作为MRD的标记,除非没有其它标记;FLT3-ITD, FLT3-TKD,NRAS,KRAS,DNMT3A,ASXL1,IDH1,IDH2,MLL-PTD和EVI1的表达不能单独作为MRD的标记,可与第2种标记结合进行分析。NPM1,RUNX1,TP53,IKZF1基因突变和IG/TCR基因重排可作为MRD的标记,但克隆造血相关的基因突变如DNMT3A、TET2、ASXL1不适合做MRD标记(克隆造血相关的基因突变可见于正常高龄人群当中)。

目前北京高博博仁医院可进行56种常见血液肿瘤的融合基因筛查,还可以利用NGS进行超过300种融合基因的筛查。我们可以通过深度测序进行339种血液肿瘤基因突变筛查并给予靶向药物指导建议以及IG/TCR克隆重排的检测。
2、维持治疗也重要
对于容易复发、移植前MRD未达到阴性或存在高危基因突变等患者,移植后情况允许时应尽可能通过维持治疗预防复发。研究表明,移植后进行维持治疗能够显著改善患者的生存。
目前可选择的靶向药物包括:
• TKI:达沙替尼、伊马替尼、普纳替尼等;
• Flt3抑制剂:索拉菲尼、舒尼替尼等;
• BCL-2抑制剂:维奈克拉;
• 去甲基化药物:地西他滨、阿扎胞苷;
• 组蛋白去乙酰化酶(HDAC)抑制剂:西达苯胺;
• MEK抑制剂:曲美替尼、考比替尼;
• PARP抑制剂:奥拉帕利;
• mTOR抑制剂:西罗莫司、依维莫司。
另外,移植后供者淋巴细胞有抗白血病作用。因此,移植后保持轻度GVHD,与无GVHD和重度GVHD相比,可以更好的改善患者生存。
总结
Allo-HSCT的疗效,与移植前的疾病状态、移植方案的制定、供者的选择及移植后MRD的监测与维持治疗息息相关。移植前力争达到MRD阴性的完全缓解;对于化疗难以治愈且威胁生命的白血病应在疾病早期移植。根据疾病的复发风险,应选择恰当的预处理方案,平衡疗效与安全性;免疫抑制剂的应用方案也应该根据复发风险而定。供者选择需要根据HLA配型、造血及免疫功能、健康状况及肿瘤遗传易感基因背景等多种参数综合决定。移植后需定期监测MRD,阴转阳需及时干预,尽量避免血液学复发;对复发风险高的患者建议给予维持治疗至移植后2年。
只有在各个方面都进行妥善的处理,移植才能够取得更好的疗效,患者才能得到最好的获益!
■ 本文专家介绍

高博医学(血液病)北京研究中心北京高博博仁医院造血干细胞移植科主任,医疗院长。
亚太骨髓移植学会学术委员会委员,中国抗癌协会血液肿瘤专业委员会常委及造血干细胞移植与细胞治疗学组副组长,血液病数字诊疗专业委员会主任委员,女医师协会靶向专业委员会副主任委员,中国医院协会血液学机构分会副主任委员。
毕业于北京医科大学(现北京大学医学部)医疗系。1986年-2006年在北京大学人民医院血液病研究所历任住院医、主治医、副主任医师,从事血液病的诊断与治疗,自1987年起主要的工作领域为造血干细胞移植。2017年5月起任北京高博博仁医院造血干细胞移植科主任及医疗院长。1994年在中国医学科学院病毒学研究所进修病毒诊断学。1996年-2000年在美国NIH(国立卫生研究院)心肺血液所做博士后,主要研究方向为造血干细胞基因治疗。
从事造血干细胞移植30余年,是国际知名的造血干细胞移植专家。有数千例移植经验,对移植方式的选择,重症移植物抗宿主病(GVHD)和感染的救治,难治/复发白血病的移植及移植后复发的防治,移植后的免疫治疗(针对白血病、病毒、真菌),老年白血病的移植,CART缓解后序贯移植,二次异基因移植等均有独到的成功经验。发表论文80余篇,在国际会议上发言数十次。
中华医学会血液学分会会员,美国血液学会会员,国际血液学会会员,亚太骨髓移植学会(APBMT)会员及学术委员会委员,中国抗癌协会血液肿瘤专业委员会常委及造血干细胞移植与细胞治疗学组副组长,女医师协会靶向专业委员会副主任委员,女医师协会血液专业委员会常委,中国医师协会整合医学分会整合血液病专业委员会委员,中国医院协会血液学机构分会副主任委员。任《中华血液学杂志》、《Hematology/Oncology and Stem Cell Therapy》及《Blood中文版》编委,《Hematology and Oncology Discovery》执行主编。
曾荣获优秀教师奖,英语教学二等奖,中华医学科技进步二等奖,北京市科技进步一等奖,解放军总后勤部科技进步二等奖,APBMT十佳论文奖及杰出发言奖。
各位血液病战友,
想一起讨论疾病相关问题及经验
听康复战友分享经验
扫码添加【博仁安安】微信
备注“移植”获邀加入~





 京公网安备11010602050084号
京公网安备11010602050084号

